UV-Visible : résonances électroniques
Transitions électroniques
La spectroscopie UV-visible met en jeu les photons absorbés puis émis lors de transitions électroniques au sein des atomes, des ions, des molécules ou des complexes chimiques. La gamme des longueurs d'ondes s'étend d'environ 200 nm (UV) à environ 800 nm.
Le spectre électronique est la fonction qui relie l'intensité lumineuse absorbée (ou transmise) en fonction de la longueur d'onde. Il est souvent représenté comme une fonction de l'absorbance en fonction de la longueur d'onde : A = f(λ).
Les niveaux d'énergie d'un atome étant quantifiés, celui-ci ne peut absorber que des photons dont l'énergie correspond à une transition entre deux niveaux d'énergie.
Dans le cas où le photon incident possède une énergie différente :
Si celle-ci est inférieure à l'énergie d'ionisation, l'atome ne l'absorbe pas et le photon est transmis.
Si celle-ci est supérieure à l'énergie d'ionisation, l'électron quitte l'atome avec une énergie cinétique (vitesse) correspondant au surplus d'énergie.
Dans le cas où l'énergie correspond à une transition possible, l'électron quitte la couche de plus basse énergie pour gagner une couche d'énergie plus grande. La lumière est alors absorbée ce qui explique les spectres d'absorption. Elle est ensuite réémise dans une direction aléatoire lorsque l'électron se désexcite : c'est la diffusion.
Les électrons présents dans les liaisons interatomiques présentent une multitude de niveaux d'énergie rapprochés. On obtient alors un spectre d'absorption de bande contrairement au spectre d'un atome isolé qui est un spectre de raie. | 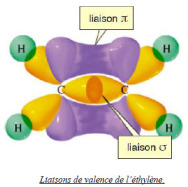 Ethylene |
Chromophores
Un chromophore est un groupement d'atomes comportant des liaisons multiples formant une alternance régulière : liaison multiple – liaison simple. On parle alors de liaisons conjuguées. Ces chromophores créent un nuage électronique délocalisé qui peut facilement entrer en résonance avec le rayonnement visible et l'absorber en partie : ils sont ainsi responsables de l'aspect coloré de la substance (d'où leur nom signifiant en grec ancien : « porteur de couleur»).
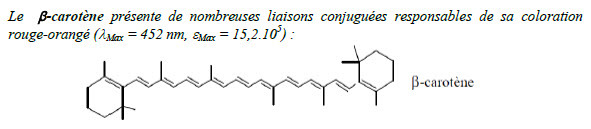
Auxochromes
Une substance colorée possède parfois des groupes auxochromes : ce sont des groupements ionisables liés aux chromophores qui permettent, d'une part de fixer les colorants sur les substrats, et d'autre part d'amplifier la couleur, c'est à dire d'élargir les bandes d'absorption. Ces groupes auxochromes augmentent la délocalisation électronique, modifiant ainsi les énergies d'absorption donc les coefficients d'extinction molaires ε et les longueurs d'onde d'absorption λ.
La plupart des auxochromes sont des groupements pouvant former des sels. Ce sont des acides ou des bases susceptibles de se fixer seuls sur le support (colorant réactif) et de résister à la lumière, à l'eau ou au savon.
Ces effets sont influencés par le solvant et l'état physique du constituant.






