Les éléments de la chimie organique
Les molécules
Les molécules de la chimie organique sont essentiellement formées à partir des éléments carbone et hydrogène. On trouve en moindre quantité les éléments azote et oxygène ainsi que les éléments de la famille des halogènes.
L'élément carbone
L'atome de carbone possède 6 électrons qui se repartissent en deux couches :
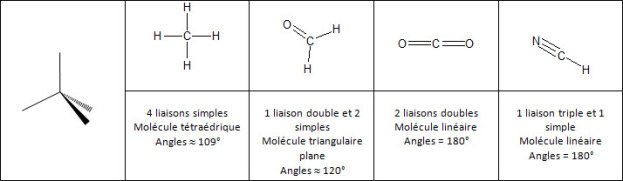
Le carbone a donc besoin de 4 électrons afin de saturer sa couche externe (règle de l'octet). Il va former avec d'autres atomes 4 doublets électroniques liants. | 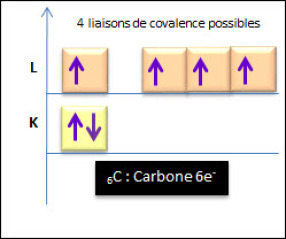 Répartition électronique du carbone |
L'élément azote
L'atome d'azote possède 7 électrons qui se repartissent en deux couches :
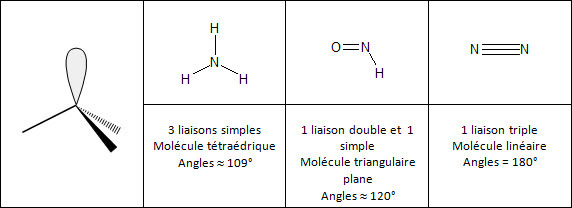
L'azote a donc besoin de 3 électrons afin de saturer sa couche externe (règle de l'octet). Possédant un doublet est non liant, il va former avec d'autres atomes 3 doublets électroniques liants. | 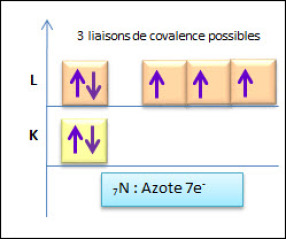 Répartition électronique de l'azote |
L'élément oxygène
L'atome d'oxygène possède 8 électrons qui se repartissent en deux couches :
L'oxygène a donc besoin de 2 électrons afin de saturer sa couche externe (règle de l'octet). Possédant deux doublets non liants, il va former avec d'autres atomes 2 doublets électroniques liants. | 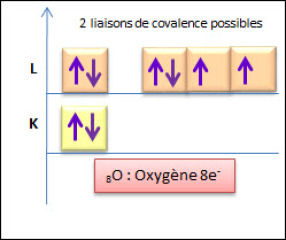 Répartition électronique de l'oxygène |
Les autres éléments
Les halogènes ( fluor : 9F , Chlore : 17Cl , Brome : 35Br , Iode : 53I ) sont susceptibles d'engager 1 électron dans une liaison de covalence, il possède alors 3 doublets non liants.
L'hydrogène 1H ne possède qu'un électron qu'il est susceptible d'engager dans une liaison de covalence.
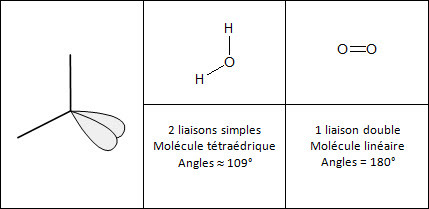
Remarque : Pour déterminer la géométrie d'une molécule autour d'un atome central, il faut tenir compte de ses doublets non liants et assimiler les doubles ou les triples liaisons à des liaisons uniques.
Solubilité et réactivité
Les chaînes carbonées sont peu ou pas polarisées, ce qui explique leur faible ou non solubilité dans un solvant polarisé tel que l'eau.
Les chaînes carbonées ont beaucoup d'affinités entre elles ce qui explique leur solubilité dans des solvants organiques.
La présence d'un atome d'oxygène qui est très électronégatif (attire les électrons) fragilise les liaisons de covalence autour de lui et rendent donc la molécule plus réactive. Il en est de même avec l'atome d'azote à un degré moindre et des atomes d'halogènes à un degré supérieur.





